Chương 1: Cơ sở lý thuyết
Oxi hóa
Khái niệm
Oxi hóa nâng cao là quá trình phân hủy oxi hóa dựa vào gốc tự do hoạt động hydroxyl *OH được tạo ra ngay trong quá trình xử lý. Trong quá trình oxi hóa, các chất độc hại trong nước thải được chuyển thành các chất ít độc hơn hoặc tạo ra chất có khả năng lắng đọng và dễ dàng tách ra khỏi nước thải.
Gốc hydroxyl *OH là một tác nhân oxi hóa mạnh nhất (Thế oxi hóa E° = 2,7 V/ESH) trong số tất cả các tác nhân oxi hóa, có khả năng oxi hóa không chọn lựa mọi hợp chất hữu cơ (dù là loại chất khó phân hủy) biến chúng thành những hợp chất vô cơ không độc hại hay dễ phân hủy. Từ những tác nhân oxi hóa thông thường như H2O2, O3 có thể nâng cao khả năng oxi hóa bằng các phản ứng hóa học khác nhau để tạo ra gốc hydroxyl, thực hiện quá trình oxi hóa gián tiếp thông qua gốc hydroxyl.
| Tác nhân oxi hóa | Thế oxi hóa (V) |
| Gốc hydroxyl
Ozon Hydrogen peroxit Permanganat Hydrobromic axit Clo dioxit Hypocloric axit Hypoiodic acid Clo Brom Iod |
2,80
2,07 1,78 1,68 1,59 1,57 1,49 1,45 1,36 1,09 0,54 |
(Nguồn: Zhou, H. and Smith, D.H., 2001)
Đặc tính của các gốc tự do là trung hòa về điện. Mặt khác, các gốc này không tồn tại sẵn như những tác nhân oxi hóa thông thường, mà được sản sinh ngay trong quá trình phản ứng, có thời gian tồn tại rất ngắn, khoảng vài nghìn giây nhưng liên tục được sinh ra trong suốt quá trình.
Nguyên lý chung
Khi gốc tự do đã được hình thành, lập tức xảy ra hàng loạt các phản ứng kiểu chuỗi, vì thế sự hình thành gốc hydroxyl được coi như phản ứng khơi mào cho hệ các phản ứng tiếp theo. Phản ứng đặc trưng tạo ra gốc hydroxyl theo một cơ chế riêng ở mỗi quá trình. Quá trình oxi hóa các hợp chất hữu cơ có thể được thực hiện bởi 3 cơ chế:
- Tách 1 nguyên tử hydro:
*OH + RH → R* + H2O
- Phản ứng cộng ở liên kết chưa no (hydroxylation):
*OH + PhX → HOPhX*
- Trao đổi electron:
*OH + RH → RH+* + OH−
Một số quá trình oxi hóa
√ Quá trình Fenton
Trong phương pháp Fenton, tổ hợp H2O2 và muối Fe2+ được sử dụng làm tác nhân oxi hóa, nếu phản ứng xảy ra hoàn toàn một số chất hữu cơ chuyển thành nước và CO2.
- Quá trình Fenton đồng thể gồm 4 giai đoạn:
- Điều chỉnh pH phù hợp: pH ảnh hưởng tới tốc độ phản ứng và nồng độ Fe2+, từ đó ảnh
hưởng đến tốc độ phân hủy chất hữu cơ. Khoảng pH thích hợp từ 2 – 4, tối ưu nhất 2,8.
- Phản ứng oxi hóa: xảy ra sự hình thành gốc *OH hoạt tính và phản ứng oxi hóa chất hữu cơ.
Fe2+ + H2O2 → Fe3+ + *OH + OH–
Gốc *OH sau khi hình thành sẽ tham gia vào phản ứng oxi hóa các hợp chất hữu cơ có trong nước cần xử lí, chuyển chất hữu cơ từ dạng cao phân tử thành chất hữu cơ có khối lượng phân tử thấp.
CHC (cao phân tử) + *OH → CHC (phân tử thấp) + CO2 + H2O + OH–
- Trung hòa và keo tụ: sau khi quá trình oxi hóa xảy ra cần nâng pH dung dịch lên 7 để thực hiện kết tủa Fe3+.
Fe3+ + 3OH– → Fe(OH)3
Kết tủa Fe(OH)3 theo cơ chế keo tụ, đông tụ, hấp phụ một phần các chất hữu cơ cao phân tử.
- Quá trình lắng: các bông sau khi hình thành sẽ lắng xuống làm giảm nồng độ COD, màu, mùi có trong nước thải. Sau quá trình lắng, các chất hữu cơ còn lại (nếu có) chủ yếu là các hợp chất có khối lượng phân tử thấp được xử lí bằng phương pháp sinh học.
- Quá trình Fenton dị thể:
Quá trình dị thể xảy ra với H2O2 trên quặng sắt loại goethite xảy ra theo cơ chế đơn giản như sau:
- Phản ứng Fenton được khởi đầu bằng việc sinh ra Fe2+ dưới sự có mặt của H2O2 xảy ra hiện tượng khử – hòa tan goethite:
?-FeOOH(r) + 2H+ + ½ H2O2 → Fe2+ + ½ O2 + 2H2O
- Sau đó, xảy ra sự tái kết tủa Fe3+ về goethite:
Fe2+ + H2O2 → Fe3+ + *OH + OH–
Fe3+ + H2O + OH– → ?-FeOOH(r) + 2H+
- Theo cơ chế trên thì quá trình dị thể cũng tương tự như quá trình Fenton đồng thể với khởi đầu là xảy ra sự khử và hòa tan Fe2+ vào dung dịch.
Các yếu tố ảnh hưởng
- Độ pH: ảnh hưởng rất lớn đến tốc độ phản ứng và hiệu quả phân hủy chất hữu cơ. Môi trường axit rất thuận lợi cho quá trình tạo gốc hydroxyl tự do *OH, trong khi ở môi trường pH cao quá trình kết tủa xảy ra nhanh hơn quá trình khử làm giảm nguồn tạo ra Fe2+, trở thành yếu tố hạn chế của tốc độ phản ứng. Phản ứng Fenton xảy ra thuận lợi khi pH từ 3 – 5, đạt tốc độ cao nhất khi pH nằm trong khoảng hẹp trên dưới 3.
- Nồng độ H2O2: tốc độ phản ứng Fenton tăng khi nồng độ H2O2 tăng, đồng thời nồng độ H2O2 cần thiết lại phụ thuộc vào nồng độ chất ô nhiễm cần xử lý, đặc trưng là COD. Tỷ lệ mol/mol H2O2:COD thường dao động trong khoảng 0,5 – 1:1.
- Tỷ lệ Fe2+ : H2O2 ảnh hưởng đến sự tạo thành và tiêu hao gốc hydroxyl vì thế tỷ lệ Fe2+ : H2O2 tối ưu khoảng 0,3 – 1:10 mol/mol, tùy theo đối tượng chất cần xử lí mà cần xác định bằng thực nghiệm.
- Các anion vô cơ thường có mặt trong nước thải cũng có thể làm giảm hiệu quả của quá trình Fenton. Những anion thường gặp nhất bao gồm cacbonat (CO32–), bicacbonat (HCO3–), Clorit (Cl–) do chúng có khả năng “tóm bắt” các gốc hydroxyl *OH làm tiêu hao số lượng gốc hydroxyl, giảm khả năng tiến hành phản ứng oxi hóa. Một số anion khác thể tạo thành những phức chất không hoạt động với Fe3+ như gốc sunfat (SO42–), nitrat (NO3–), hydrophotphat (H2PO4–) cũng làm hiệu quả của quá trình Fenton giảm đi.
√ Quá trình Peroxon
Quá trình oxi hóa của ozon với sự có mặt của hydrogen peroxit được gọi là quá trình Peroxon. Quá trình này thực hiện sự oxi hóa chất ô nhiễm thông qua gốc hydroxyl được tạo ra từ ozon.
Ở quá trình Peroxon, do sự có mặt hydroxyl peroxit làm gia tăng đáng kể quá trình tiêu thụ và phân hủy ozon làm cho sự chuyển hóa ozon từ pha khí sang pha lỏng được tăng cường. Tuy vậy, quá trình Peroxon thường được dừng lại ở mức độ phân hủy nào đó, nhằm chuyển hóa các chất hữu cơ khó phân hủy sinh học thành những chất hữu cơ có khả năng bị phân hủy sinh học, làm cải thiện tỷ số BOD/COD trong nước thải theo hướng thuận lợi để thực hiện các quá trình xử lý sinh học tiếp theo.
Phản ứng tạo gốc *OH từ hệ O3/ H2O2
H2O2 ↔ HO2– + H+ (1)
HO2– + O3 → *O3– + *HO2
Tạo gốc *OH từ *O3–
*O3– + H+ → *HO3
*HO3 → *OH + O2
Tạo gốc *OH từ *HO2
*HO2 ↔ H+ + *O2–
*O2– + O3 → *O3– + O2
*O3– + H+ → *HO3
*HO3 → *OH + O2
Các yếu tố ảnh hưởng
- Các ion vô cơ có trong nước thải cũng có thể làm giảm hiệu quả của quá trình do chúng tìm diệt các gốc *OH vừa được tạo ra. Những phản ứng làm mất gốc hydroxyl của một số anion tìm diệt gốc hydroxyl đặc trưng như sau:
*OH + CO32– → *CO3 + OH–
*OH + HCO3– → *HCO3 + OH–
*OH + Cl– → *ClOH–
- Độ pH và độ kiềm
Trong môi trường pH cao rất thuận lợi cho phản ứng (1) xảy ra, do đó làm tăng tốc độ quá trình phân hủy ozon và tạo ra gốc *OH. Trị số pH tối ưu của quá trình Peroxon thường nằm trong khoảng 7 – 8.
Độ kiềm là một thông số quan trọng của quá trình. Nếu trong nước thải chứa độ kiềm bicacbonat và cacbonat, cần phải loại bỏ chúng trước khi tiến hành phản ứng vì khi thực hiện trong môi trường pH cao, cân bằng cacbonat-bicacbonat sẽ nhanh chóng chuyển sang tạo cacbonat là một chất tìm diệt gốc *OH.
- Tỷ lệ H2O2:O3
H2O2 + 2O3 → 2OH* + 3O2
Theo phương trình, cho thấy 1 mol H2O2 tác dụng với 2 mol O3 sẽ tạo ra 2 gốc tự do OH*. Theo các kết quả nghiên cứu, tỷ lệ tối ưu H2O2:O3 là 0,5:1 mol. Tuy nhiên, trên thực tế xảy ra sự hao hụt các chất tham gia phản ứng như hao hụt O3, H2O2 dẫn đến ảnh hưởng tới tỷ lệ H2O2:O3. Mặt khác, nếu lượng H2O2 quá dư sẽ gây tác dụng ngược vì H2O2 cũng là chất tìm diệt gốc *OH.
√ Quá trình Catazon
Catazon là một quá trình xử lý loại bỏ các hợp chất hữu cơ trong nước thải bằng cách đưa thêm vào phản ứng các chất xúc tác nhằm nâng cao hoạt tính oxi hóa của ozon.
- Quá trình Catazon đồng thể
- Chất xúc tác kiềm
Thực hiện phản ứng ozon hóa trong môi trường pH cao giúp nâng cao đáng kể năng lực oxi hóa của ozon, vì ở môi trường pH cao phản ứng giữa ion hydroxit và ozon dẫn đến sự hình thành gốc anion superoxit O2– và gốc *HO2:
O3 + OH– → *H2O +O2–
Bằng phản ứng giữa ozon và gốc anion superoxit O2–, gốc anion ozonit *O3– được hình thành, sau đó lập tức phân hủy khi có mặt ozon và tạo ra gốc *OH. Kết quả là 3 phân tử ozon tạo ra 2 gốc hydroxyl theo phản ứng sau:
3O3 + OH– + H+ → 2OH* + 4O2
- Chất xúc tác ion kim loại
Xử lí nước thải bằng ozon với các chất xúc tác đồng thể sunfat Fe (II), Mn (II), Ni (II) hoặc Co (II) có tác dụng loại bỏ chất ô nhiễm hữu cơ cao hơn so với khi sử dụng ozon đơn thuần.
Cơ chế xúc tác của Fe2+ trong quá trình ozon hóa:
Fe2+ + O3 → Fe3+ + *O3–
*O3– + H+ → *HO3
*HO3 → *OH + O2
- Quá trình Catazon dị thể
Các chất xúc tác dị thể có khả năng tăng cường đáng kể phản ứng ozon hóa. Cơ chế của quá trình này có thể xảy ra theo 2 khả năng:
- Khả năng thứ nhất: Chất xúc tác chỉ đóng vai trò như chất hấp phụ (ozon hoặc phân tử chất hữu cơ bị hấp phụ trên bề mặt), ozon và gốc hydroxyl được tạo thành là tác nhân oxi hóa.
- Khả năng thứ hai: Chất xúc tác có thể tác dụng với cả ozon và chất hữu cơ bị hấp phụ trên bề mặt, thực hiện đúng bản chất của tác dụng xúc tác.
Tuyển nổi
Khái niệm
Tuyển nổi là phương pháp được áp dụng rộng rãi nhằm tách các hạt lơ lửng, các tạp chất (dạng hạt rắn hoặc lỏng) phân tán không tan, khả năng tự lắng kém ra khỏi nước. Trong một số trường hợp, quá trình này được dùng để tách các chất hòa tan như các chất hoạt động bề mặt.
Nguyên lý chung
Quá trình tuyển nổi được xây dựng dựa trên nguyên tắc cơ bản: tạo ra bọt khí sao cho có thể ”thu hút” được dầu/chất bẩn sau đó gom bọt lại để lấy dầu/chất bẩn đó. Do đó, quá trình tuyển nổi được thực hiện bằng cách sục dòng khí phân tán vào nước để tạo ra các bọt khí li ti. Để tạo cho các tạp chất bẩn có khả năng dễ nổi, người ta cho vào nước chất tuyển nổi (tác nhân tuyển nổi) để thu hút và kéo các chất bẩn nổi lên mặt nước. Những hạt chất bẩn sẽ bám dính vào các bọt khí và cùng nổi lên bề mặt nước, sau đó chúng tập hợp lại với nhau thành các lớp bọt và cuối cùng hỗn hợp chất bẩn và chất tuyển nổi được loại ra khỏi nước.
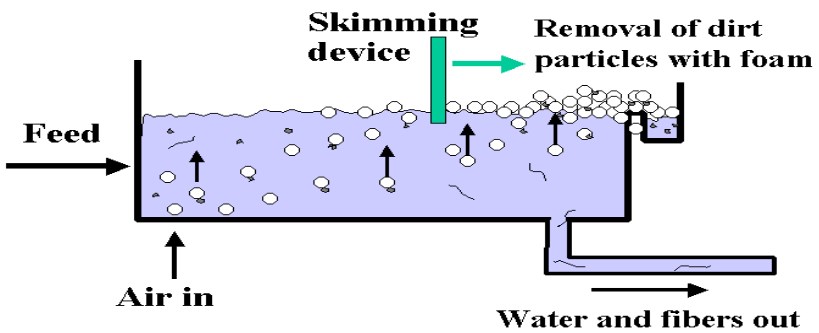
Phân loại
√ Tuyển nổi với sự tách không khí từ nước
Được sử dụng rộng rãi với nước thải chứa chất bẩn có kích thước nhỏ vì nó cho phép tạo bọt khí rất nhỏ. Thực chất của biện pháp này là tạo ra một dung dịch quá bão hoà không khí. Sau đó, không khí được tách ra khỏi dung dịch ở dạng các bọt cực nhỏ và kéo theo các chất bẩn lên mặt nước.
√ Tuyển nổi chân không
Nước thải được bão hòa không khí ở áp suất khí quyển trong buồng thông khí. Tiếp theo là do sự chênh lệch áp suất nên nước được dẫn vào ngăn tuyển nổi. Ở đó nhờ áp suất chân không, không khí được hình thành ở dạng các bọt cực nhỏ và kéo theo các chất bẩn nổi lên. Bọt cùng với các chất bẩn được gạt vào máng tới bể chứa nhờ hệ thống thành gạt. Ngoài ra, trong ngăn tuyển nổi chân không còn có hệ thống thành gạt ở đáy bể để gạt cặn lắng xuống. Nước trong được dẫn đi để xử lý tiếp tục qua hệ thống máng xung quanh. Áp suất chân không trong ngăn tuyển nổi được giữ ở khoảng 225 – 300 mmHg nhờ bơm chân không. Thời gian lưu nước trong ngăn tuyển nổi khoảng 20 phút.
| Ưu điểm | Nhược điểm |
| + Quá trình tạo bọt khí và kết dính các hạt bẩn diễn ra trong môi trường tĩnh → xác xuất vỡ thấp.
+ Chi phí năng lượng thấp. + Hiệu suất xử lý cao. |
+ Mức độ bão hòa các bọt khí trong nước thấp nên chỉ sử dụng với các loại nước thải có nồng độ chất bẩn không tan cao (>250 – 300 mg/l).
+ Phải xây lắp các thùng chân không kín và bố trí cào cơ giới bên trong → cấu tạo và quản lý khó khăn. + Bất kỳ sửa chữa nhỏ nào cũng phải ngừng toàn trạm. |
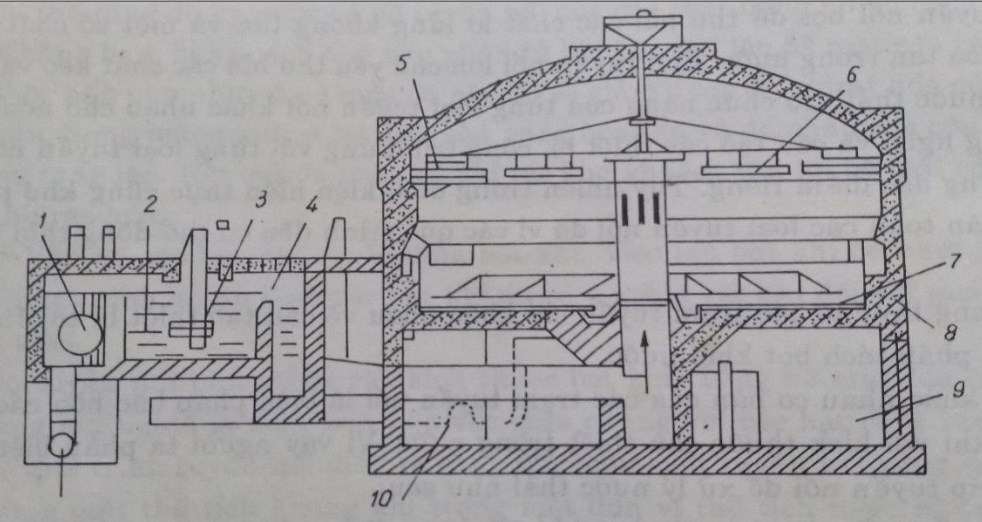
1- điều chỉnh nước vào; 2- ngăn làm thoáng tạo bọt; 3- thiết bị thổi khí;
4- thiết bị khử khí; 5- máng thu cặn tuyển nổi; 6- thanh gạt bọt; 7- thanh gạt cặn đáy;
8- máng thu nước sạch; 9- ngăn thiết bị kỹ thuật; 10- ngăn chứa cặn bọt
√ Tuyển nổi không áp lực
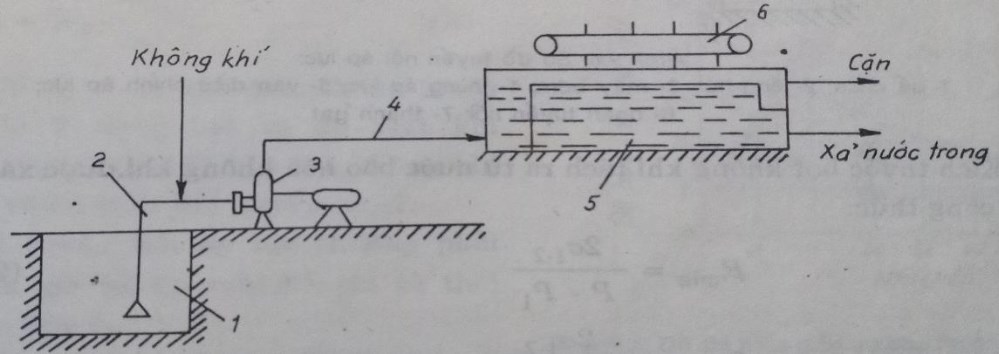
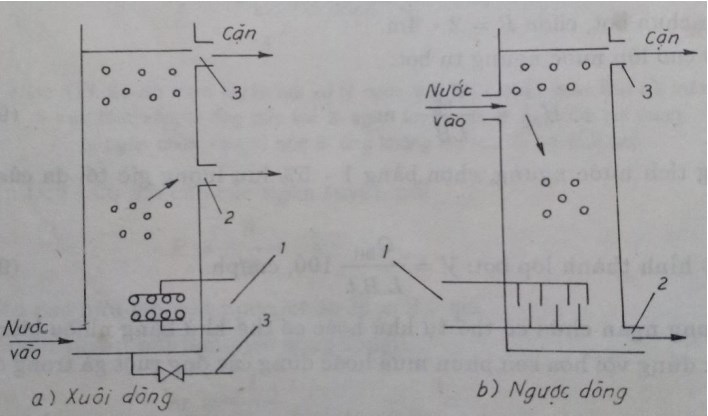
Không khí được dẫn vào ống hút máy bơm từ máy nén khí. Hỗn hợp khí – nước được tạo thành trong máy bơm và được đẩy vào bể hở – kiểu bể lắng ngang. Ở đó bọt khí nổi lên mặt nước và kéo theo các tạp chất bẩn. Nước trong được dẫn đi riêng biệt với bọt và các chất bẩn.
- Nhược điểm: Khó điều chỉnh lượng không khí do đó làm việc không ổn định. Máy bơm chỉ tạo được các bọt khí lớn nên hiệu suất tuyển nổi không cao, nhất là đối với các chất bẩn nhỏ.
√ Tuyển nổi áp lực
Nước được đưa vào bồn khí tan bằng bơm áp lực cao, không khí được cấp vào bồn khí tan bằng máy nén khí, tại đây nước và không khí được hòa trộn. Nước bão hòa không khí chảy vào ngăn tuyển nổi của bể tuyển nổi, qua một van giảm áp thì áp suất được giảm đột ngột về áp suất khí quyển. Khí hòa tan được tách ra và dính bám vào các hạt cặn trong nước, quá trình tuyển nổi được hình thành.
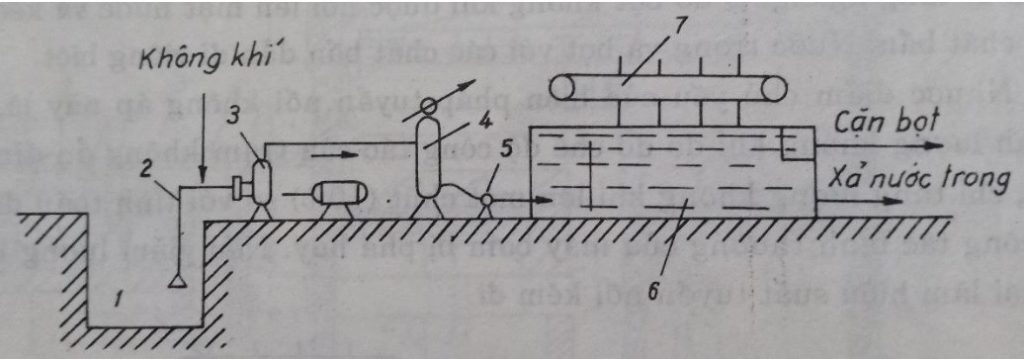
1 – bể chứa; 2- ống hút máy bơm; 3- máy bơm; 4- ống đẩy máy bơm; 5- ngăn tuyển nổi; 6 – thanh gạt
| Ưu điểm | Nhược điểm |
| + Cho phép làm sạch nước với nồng độ tạp chất lơ lửng tới 4 – 5 g/l.
+ Cho phép điều chỉnh độ bão hòa trong một khoảng rộng. |
+ Chỉ dùng khi lượng nước thải nhỏ.
+ Tiêu hao nhiều năng lượng. |
√ Tuyển nổi với trạm bơm bằng khí nén
Nước được bão hòa không khí dưới áp lực cao rồi lại tách không khí ra hạ áp lực xuống cũng như tuyển nổi áp lực. Quá trình phân tán và cắt nhỏ các bọt khí khi thổi vào cũng như khi chúng được nổi lên trên đóng vai trò rất quan trọng.
| Ưu điểm | Nhược điểm |
| + Giảm năng lượng tiêu hao 2 – 4
lần so với tuyển nổi áp lực và phân tán không khí bằng cơ giới. + Chi phí xây dựng thấp. |
+ Ngăn tuyển nổi phải được bố trí cao. |
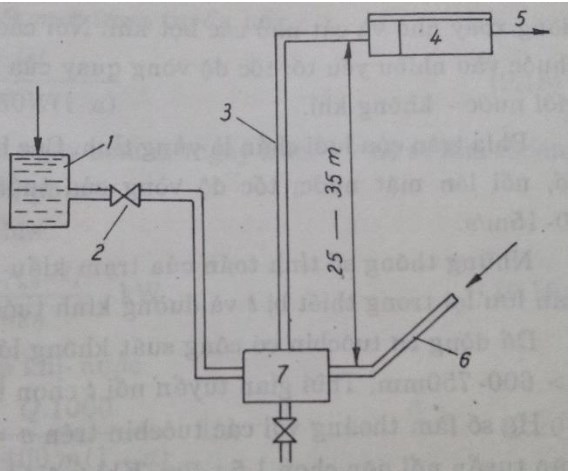
1 – thùng cung cấp; 2- ống dẫn nước; 3-ống dẫn hỗn hợp khí nén-nước; 4-ngăn tuyển nổi; 5- nước sạch; 6- ống dẫn khí nén; 7- vòi phun hòa trộn
√ Tuyển nổi với sự phân tán không khí bằng cơ giới
Khi tuabin quay nhanh, sau các cánh quạt sẽ tạo ra áp suất chân không, do đó không khí từ khí quyển bên ngoài được hút vào theo ống dẫn rồi phân tán thành những bọt nhỏ trong nước. Khi cánh quạt quay thì hỗn hợp không khí nước được trộn lẫn dạng nhũ tương và bắn ra ngoài. Xung quanh có lưới chắn để hỗn hợp khí – nước về trạng thái tĩnh. Như vậy trong vùng đó tạo vô số dòng xoáy nhỏ và cắt nhỏ các bọt khí.
Ở thiết bị này, mức độ phân tán khí quyết định hiệu suất tuyển nổi: khi mức độ phân tán khí cao thì bọt khí càng nhỏ → hiệu suất cao. Tuy nhiên, nếu vận tốc quay cao sẽ làm tăng đột ngột dòng chảy rối và làm phá vỡ tổ hợp hạt – khí dẫn đến giảm hiệu quả.

1- ngăn tạo chân không; 2-ngăn tuyển nổi; 3-trục máy; 4-ống dẫn không khí; 5-động cơ; 6- máy hút bọt; 7- lỗ ở stato; 8- stato; 9- máy hướng trục; 10- ngăn thu nước; 11- ngăn xả nước.
| Ưu điểm | Nhược điểm |
| + Xử lý nước có nồng độ các chất lơ lửng cao (>2.000 – 3.000mg/l).
+ Cho phép tạo các bọt khí khá nhỏ |
+ Đòi hỏi mức độ bão hòa không khí cao 0,1 –0,5m3 không khí/m3 nước thải.
+ Thiết bị cơ giới phải được sửa chữa và thay thế thường xuyên. + Việc bảo trì có thể gặp nguy hiểm. |
√ Tuyển nổi với thổi không khí nén
- Tuyển nổi với thổi không khí nén qua các vòi
Phương pháp này được sử dụng để xử lý nước thải chứa các tạp chất tan dễ ăn mòn các thiết bị cơ giới có các chi tiết chuyển động. Không khí được phân tán vào ngăn tuyển nổi qua các vòi phun đặc biệt đặt trên các ống phân phối không khí. Bọt cũng được tách khỏi nước nhờ hệ thống gạt.
- Tuyển nổi với phân tán không khí qua các tấm xốp
Khi thổi không khí qua các lỗ nhỏ có thể tạo ra những bọt khí cực nhỏ và có thể tuyển nổi được các chất bẩn. Muốn vậy, tốc độ không khí ra khỏi các lỗ nhỏ không dính vào nhau, tránh tạo các bọt khí lớn hơn. Bọt tạo thành được thổi liên tục từ ngăn tuyển nổi sang ngăn chứa và khử. Tại đây, bọt có thể tự khử hoặc được khử bằng các biện pháp: dùng vòi hoa sen phun mưa hay dùng các ống ruột gà trong đó dẫn hơi nóng.
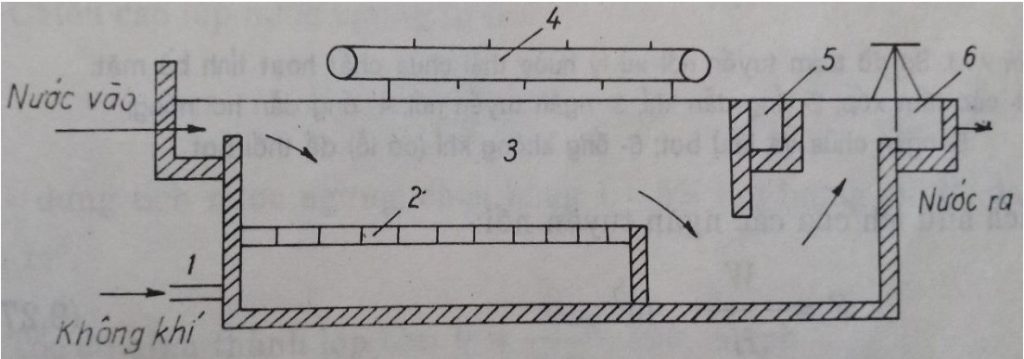
1-ống dẫn khí; 2-các tấm xốp; 3-ngăn tuyển nổi; 4-hệ thống gạt bọt; 5-màng thu bọt cặn; 6- thiết bị điều chỉnh mực nước ở cửa ra
| Ưu điểm | Nhược điểm |
| + Cấu tạo ngăn tuyển nổi đơn giản.
+ Ít tốn điện năng.
+ Không cần thiết bị phức tạp. |
+ Các lỗ xốp dễ bị tắc.
+ Khó chọn vật liệu xốp đắp ứng yêu cầu về kích thước bọt khí đồng đều. |
√ Tuyển nổi điện
Khi có dòng điện một chiều đi qua nước thải, hydro được giải phóng ở catot và oxy ở anot. Kết quả nước thải được bão hòa bởi các bọt khí đó rồi kéo theo các chất bẩn không tan nổi lên mặt nước.
Khi sử dụng các điện cực tan (sắt hoặc nhôm) thì ở cực anot sẽ diễn ra quá trình hòa tan kim loại. Kết quả sẽ có các cation kim loại chuyển vào nước. Những cation đó sẽ cùng nhóm hydroxyl và tạo thành hydroxide là những chất keo tụ phổ biến. Do đó, trong không gian giữa các điện cực sẽ đồng thời diễn ra các quá trình keo tụ tạo bông và tạo ra các bọt khí, tạo điều kiện để bọt khí bám vào bông cũng như làm quá trình keo tụ chất bẩn, quá trình hấp phụ, kết dính,… diễn ra mạnh và hiệu suất tuyển nổi cao hơn.
- Ưu điểm: Cho phép xử lý ở tốc độ rất cao.
- Nhược điểm: Tốn nhiều năng lượng, thiết bị đắt tiền.
1- hệ điện cực; 2- xả nước sạch; 3- xả cặn
√ Tuyển nổi sinh học và hóa học
Phương pháp này dùng để nén cặn từ bể lắng đợt 1 khi xử lý nước thải. Cặn này được tập trung vào bể đặc biệt và đun nóng bằng hơi nước ở 35- 550C trong vài ngày.
Do sinh vật phát triển và tạo các bọt khí nổi lên, kéo theo các hạt cặn cũng nổi lên rồi được gạt đi. Bằng cách này, độ ẩm của cặn chỉ còn 80% giúp cho quá trình xử lý sau đó thuận lợi hơn.
Khi cho phèn vào nước thải song song với các quá trình hóa học, có thể tạo ra các bọt khí như O2, CO2,Cl2… Các bọt khí này cũng nổi lên kéo theo các chất bẩn không tan trong nước thải. Khi tuyển nổi hóa học thì đầu tiên nước thải phải được qua bể trộn rồi mới qua ngăn tuyển nổi. Thời gian lưu nước trong bể trộn không ít hơn 3 – 5 phút để diễn ra phản ứng và tạo bọt.